Full Mecánica
Para todos los amantes de la Tecnología Mecánica
(C) Causas de la corrosión / proteccion contra la corrosión / ánodos de desgaste / electrodos de sacrificio.
Anualmente se pierden enormes cantidades de dinero por la corrosión de metales en el aire, en la tierra y en el agua.
La (fig. 1) muestra un metal dañado por la corrosión.

Esta empieza en la superficie y puede llegar a la total destrucción del metal. Debida a reacciones químicas o electroquímicas con el ambiente la corrosión provoca que los metales se transformen en iones metálicos. Las combinaciones de metales diferentes son las más amenazas. (ver cuadro siguiente ).
Transformación de los metales debido a la corrosión

En los apartados siguientes se estudian los fenómenos eléctricos y químicos que se producen durante la corrosión.
Acción de gases y líquidos
El aire se compone de los siguientes gases:
Nitrógeno 78.09% Gases nobles 0.93%
Oxigeno 20.95% Dióxido de carbono 0.03%
El nitrógeno, los gases nobles y el dióxido de carbono no contribuyen a la corrosión. En cambio, el oxigeno se combina con los metales formando óxidos. En muchos casos la capa de oxido es compacta y evita el avance ulterior de la corrosión (por ejemplo, el óxido de aluminio). Sin embargo, otros agentes adicionales, como por ejemplo sales y agua, destruyen esta capa protectora y provoca con ello la descomposición total del metal (fig. 2).

A la corrosión también contribuyen algunos productos, provocados por procesos de combustión, que polucionan en aire. Así, por ejemplo, el dióxido de azufre forma con el agua acido sulfuroso, y este ataca los metales.
La acción del agua en la corrosión esta siempre relacionada con la del oxígeno.
Ejemplo:
A partir del oxido de zinc se forma hidróxido de zinc por la acción del agua. La oxidación del hierro es una corrosión especial y bastante rápida. En realidad el proceso es relativamente complicado. La oxidación se produce debido a la acción del oxígeno y del agua. Se forman así diferentes hidróxidos de hierro, cuyos volúmenes específicos son diferentes, con lo que la capa de óxido se agrieta y permite que la corrosión continúe rápidamente su avance.
La amenaza de corrosión es aún mayor cuando existen ácidos y lejías, pues disuelven lentamente los metales innobles. Cuanto más innoble sea el metal mayor será la corrosión.
Corrosión por formación de pilas galvánicas
En los puntos de contacto de dos metales diferentes se producen fuertes corrosiones cuando en el espacio intermedio se deposita humedad. Veamos como ejemplo un ángulo de hierro al que se ha atornillado una chapa de cobre (fig. 4).
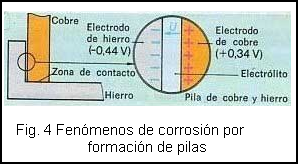
En el espacio intermedio ha penetrado la humedad, que actúa como un electrolito, dando lugar a la formación de una pila electrolítica de tensión 0.78 V pero con los polos de la fuente en circuitados (por el contacto de los metales en algunos puntos), y por tanto con una corriente circulando de manera contínua provocando la entrada de iones de hierro en el electrolito, lo que produce la disolución del electrodo de hierro extendiéndose la corrosión.
Cuando entre dos metales diferentes penetre la humedad se formará una pila galvánica. El metal menos noble se disolverá.
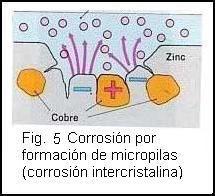
Los metales empleados en la técnica no son puros, sino que están más o menos dotados de sustancias extrañas. Entre ellas son nocivas otros metales y el carbono. Si además en la superficie se encuentra una película de agua se formarán micropilas que contribuirán a la destrucción del metal. La (fig.5 ) muestra esquemáticamente una superficie de zinc impurificada por átomos de cobre. Por el cortocircuito de los polos de la pila circulará una corriente, que provocará la disolución de los iones de zinc en el electrólito. Así se estropeará la superficie y aparecerán grietas.
Una posible medida de protección contra la corrosión es el revestimiento de la superficie, como el acero, con otros metales, por ejemplo zinc, estaño o níquel. Los agentes externos también provocan una capa de corrosión sobre dichos metales, capa que sin embargo es compacta y resistente, con lo que protege el metal que se encuentra bajo ella.
La protección desaparece cuando esta capa resulta dañada mecánicamente en algunos puntos y queda el hierro al descubierto. En los puntos dañados se producirá una corrosión muy intensa. La causa de ella vuelve a ser la formación de pilas electroquímicas
Proceso químico de la disolución:
Corrosión por corrientes derivadas
Dado que la causa de toda corrosión electroquímica se encuentra en la circulación de una corriente, la corrosión también se presentará en los circuitos de corriente continua, y precisamente en aquellos puntos en los que los iones se disuelven en un electrolito. Decimos que se produce una corrosión por corriente derivada cuando el circuito principal de la corriente puede salirse una parte de ella, la corriente derivada. En principio no se trata más que de una electrólisis.
Para aclarar estos hechos vamos a describir brevemente un experimento ( fig. 6 )

En el electrólito se encuentran sumergidos dos electrodos de zinc. Debido a la circulación de la corriente se descompone el ánodo, pues en él los iones positivos pueden entrar a formar parte de la disolución.
Como ejemplo práctico nos servirá un terminal de la batería de un coche.
La humedad presente se encarga de que al circuito principal se encuentre conectado otro circuito en paralelo, por el que puede circular la corriente derivada ( fig. 7 ).

Engrasando los terminales puede impedirse la entrada del agua, y por tanto la corrosión
La corrosión por corrientes derivadas se produce en el ánodo
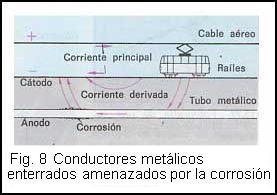
Piezas amenazadas son, por ejemplo, los tubos metálicos que discurran enterrados, y también los revestimientos metálicos de las tomas de tierra cuando circulen corrientes continuas por la tierra.
En los tranvías, por ejemplo, la corriente continua llega por el cable aéreo y vuelve al generador por los raíles. En especial las interrupciones de éstos provocan que la corriente circule bajo tierra, tomando preferentemente para ello los conductores metálicos que se encuentran enterrados. Los iones de los conductores enterrados se disuelven en la tierra destruyendo así el conductor metálico( fig. 8 )
La corrosión puede impedirse uniendo las canalizaciones de tubos o los revestimientos metálicos de cables directamente con los raíles mediante un conductor metálico( fig. 9 )
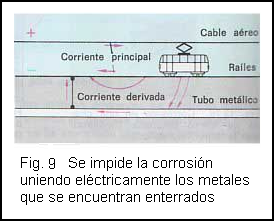
La corriente que antes circulaba por los tubos y a través de la tierra hasta los raíles circulara ahora por el camino eléctricamente más favorable, que es el conductor metálico de unión. De este modo se evita la corrosión.
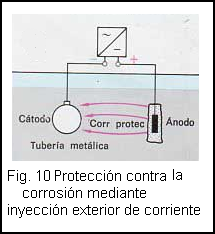
La protección es aun mejor si se inyecta en la tierra una corriente de protección. El material a proteger se convertirá en el cátodo gracias a la fuente de tensión, con lo que los iones no podrán salir de él (fig.10 ).
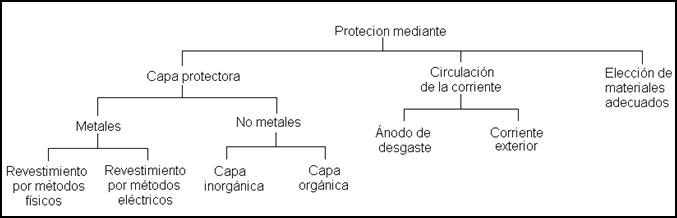
Protección contra la corrosión
Es inevitable el tener que emplear medidas protectoras contra la corrosión. Para ello existen diversas posibilidades.
Como la corrosión empieza siempre en la superficie deberemos proteger ésta contra la acción de sustancias nocivas. Métodos sencillos y eficaces son las pinturas de color y los esmaltes. Las pinturas que contienen plomo son especialmente eficaces.
Para que estas sustancias se adhieran bien es necesario que la superficie esté seca y exenta de óxidos antes de tratarla. Como las pinturas de color presentan una relativa porosidad será necesario utilizar varias capas. Es frecuente el utilizar entonces pinturas diferentes (primera capa, esmalte .etc.)
Los metales forman en su superficie capas de óxido o de hidróxido. Si estas son delgadas y sin poros el metal inferior quedara protegido automáticamente. Para mejorar la protección pueden reforzarse esta capa electrolíticamente. Los poros restantes pueden taponarse con pinturas o por impregnación.
Los revestimientos metálicos pueden obtenerse por inmersión en metales fundidos, por vaporización, mediante electrólisis o por pulverización. Sin embargo, todos estos procedimientos sólo serán una protección eficaz si la superficie no queda dañada.
Un revestimiento plástico de una superficie metálica es una protección muy eficaz. Sin embargo, debe vigilarse que la capa de plástico quede bien adherida, pues si no se podrán forman zonas de corrosión en los huecos.
Los objetos amenazados por la corrosión que se encuentren enterrados (por ejemplo, depósitos de petróleo, tubos, raíles, cables) precisan una atención especial, pues en la tierra húmeda siempre se encuentran electrólitos. Una protección eficaz contra la corrosión se consigue con los anodos de desgaste (anodo de desgaste). Para ello se conecta el objeto con un electrodo de un material diferente, obteniendo así una pila galvánica. El electrodo menos noble se disolverá paulatinamente. La corrosión se traslada del objeto a proteger al ánodo de desgaste, que podemos cambiar por otro cuando sea necesario.
La (fig. 11 ) nos muestra la protección de un tubo de acero mediante un bloque hecho de una aleación de magnesio. Frecuentemente se emplean ánodos de desgate de aleaciones de zinc debido a su mayor duración.
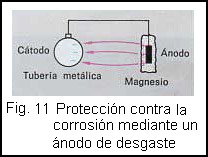
Este procedimiento se emplea también, por ejemplo, para proteger las estructuras metálicas de los puentes. Un bloque de zinc, unido eléctricamente con el acero, se sumerge, por ejemplo, en el agua
Una buena protección se suele lograr también con el método de las corrientes exteriores (protección activa contra la corrosión). La corriente protectora se inyecta en el suelo mediante una fuente de alimentación (fig.11 ). No es preciso que el ánodo sea de un material menos noble que el objeto a proteger, pues se convierte en ánodo gracias a la polaridad de la fuente de tensión. Los iones solamente pueden salir del ánodo, con lo que quedan protegidos los objetos conectados como cátodo.
En general los ánodos que se entierran son de aleaciones de silicio y hierro colado, pues este material se descompone con lentitud. Además se rodean con un asentamiento de coque.
Este procedimiento de protección se puede emplear también para interiores.
La ( fig.12 ) nos muestra la protección interna de un depósito de agua potable.

El ánodo puede ser, por ejemplo, de titanio chapeado.
Para evitar la corrosión deberá tenerse en cuenta lo siguiente:
- Las superficies amenazadas por la corrosión deberán revestirse ( o bien engrasarse)
- Los puntos por donde la corriente pase de un metal a otro deberán estar especialmente protegidos
- En las juntas de dos metales diferentes se emplearan a ser posible sólo metales que se encuentren muy próximos en la serie de potenciales de electrodo. Si no fuera posible esto, se procurara un aislamiento suficiente ente ambos.
Métodos de protección contra la corrosión